可逆反応と不可逆反応とは
正逆両方向に進む反応を可逆反応、正方向にのみ進み逆反応が起きないものを不可逆反応といいます。
可逆反応では時間が経つと濃度に変化が現れなくなる状態が生じ、これを平衡状態といいます。
物質Aが化学反応により物質Bに変化すると同時に、物質Bが物質Aに戻る反応が起こることをまとめて可逆反応といいます。このとき、反応式の右に進む反応を正反応、左に進む反応を逆反応といい、一般に各々異なった速度定数をもっています。
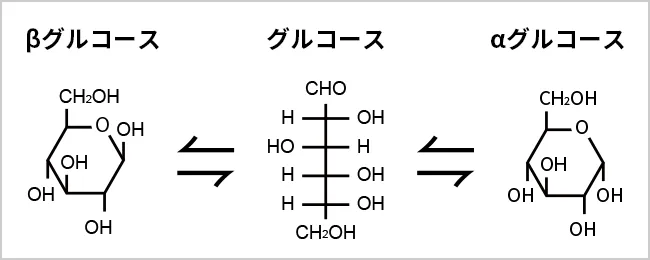
可逆反応の例として、グルコースの異性化(図)があります。水溶液中ではαグルコース、βグルコースの形で存在し、鎮状の形で存在することはほとんどありません。
グルコースの異性化
反応が進むにつれ物質Aは減少し、物質Bは生成するのですが時間が経過するほどBはAに戻ります。そして正反応によるAの減少速度と、逆反応によるAの生成速度が等しくなると、A、B両者の濃度とも見かけ上は変化しなくなります。このような状態を平衡状態といいます。 ここでわかるように、平衡反応は正逆両方の反応速度が等しいために見かけ上の変化はないものの、反応は正しく起きています。
参考文献
バイオ研究者が知っておきたい化学の必須知識
発行所:株式会社羊土社/著者:齋藤 勝裕/p.118~119





